Prix des médicaments : des brevets abusifs comme remparts contre la concurrence
Patrick Durisch, 30 août 2024
 ©
Teacher photo/Shutterstock
©
Teacher photo/Shutterstock
Un nouveau médicament n’est pas protégé par un seul, mais par des dizaines, voire parfois plus d’une centaine de brevets. On parle alors de « jungle de brevets » (« patent thickets » en anglais). Ceux-ci sont déposés de manière étalée dans le temps, ce qui signifie que la durée du monopole d’un produit dépasse souvent largement les vingt ans théoriques prévus par l’Accord sur la propriété intellectuelle (ADPIC) de l’Organisation mondiale du commerce (OMC). Une stratégie d’accumulation sans fin de brevets qualifiée d’« evergreening » en anglais.
Il convient de distinguer deux types de brevets :
les brevets primaires portant sur la ou les molécules et déposés tôt dans la phase de développement ;
les brevets secondaires, déposés juste avant ou au cours de la phase de commercialisation, qui prolongent la durée d’exclusivité commerciale sans apporter de véritable plus-value thérapeutique.
Si tout brevet constitue une exception au libre-marché, les secondaires sont ceux qui ont le plus d’impact sur la concurrence et les prix – d’autant qu’ils ont proliféré ces dernières années, en particulier aux États-Unis où ils sont plus facilement délivrés.
Des brevets secondaires accordés en masse
Chaque année, la Suisse se vante d’être l’un des « pays les plus innovants », en se basant simplement sur le nombre de brevets déposés. Or, dans le domaine des médicaments en tout cas, la grande majorité est injustifiée. Les grands groupes pharmaceutiques ont en effet vite compris les avantages financiers qu’ils pouvaient retirer de ces remparts de brevets abusifs qui barrent la route de leurs concurrents. À l’autre bout de la chaîne, les patient·e·s doivent payer leurs traitements au prix fort pendant plus longtemps, sans aucune justification valable.
Rappelons que le brevet est un droit exclusif qui permet au titulaire d’une invention d’interdire à des tiers de la fabriquer et de la commercialiser. Mais c’est un droit territorial : si une entreprise pharmaceutique veut protéger son médicament dans plusieurs pays, elle doit en faire la demande dans chacun d’entre eux – sauf en Europe, où l’Office européen des brevets (OEB), qui réunit 39 pays dont la Suisse, dispose d’une procédure centralisée valable simultanément dans toutes ces juridictions.
Rappelons aussi qu’une invention doit répondre à trois exigences générales pour être brevetée : (1) être nouvelle (2) impliquer une activité inventive (3) être susceptible d’application industrielle. Une demande de brevet sur un médicament n’est donc pas jugée en fonction de l’utilité du traitement, mais seul le fait d’être une « nouvelle invention » est pris en compte, même s’il ne s’agit que d’une modification mineure d’un produit déjà existant.
L’accord ADPIC laisse une grande marge de manœuvre aux États membres de l’OMC pour décider quelle invention mérite un brevet ou non, tant que les trois exigences sont respectées. Ainsi, selon la législation en vigueur et la minutie avec laquelle les demandes sont examinées, les brevets sont soit octroyés en masse (comme aux États-Unis) ; de manière un peu plus restreinte car parfois contestés (comme en Europe) ; ou avec parcimonie en raison de clauses plus restrictives visant à éviter de récompenser des pseudo-innovations qui mettent en péril le droit à la santé (comme en Inde). Ces approches ont des conséquences très différentes en matière de concurrence et d’accès aux médicaments, avec une arrivée sur le marché plus ou moins tardive, selon les pays, de génériques vendus à des prix plus faibles.
 ©
2024 Bloomberg Finance LP
©
2024 Bloomberg Finance LP
Les États-Unis, véritable eldorado de la pharma
Comme dans bon nombre d’autres secteurs, les États-Unis dictent le ton dans le domaine pharmaceutique. Avec plus de 600 milliards de dollars US annuels, le pays de l’Oncle Sam représente à lui seul plus de la moitié du marché pharmaceutique mondial. Un terrain de jeu essentiel pour Roche et Novartis, respectivement deuxième et huitième mondial en termes de chiffre d’affaires en 2023.
Les géants bâlois sont membres de longue date du puissant lobby de la pharma aux États-Unis (Pharmaceutical Research and Manufacturers of America ou PhRMA), qui a pignon sur rue auprès du Congrès et de la Maison-Blanche. Le CEO de Novartis en assure même la présidence depuis 2023. Aux États-Unis, les pharmas bénéficient de nombreux incitatifs et de gros avantages fiscaux dans le domaine de la recherche, ainsi que d’une politique très généreuse en matière de brevets et d’un système judiciaire propice pour initier des litiges à tout-va. La procédure d’autorisation de mise sur le marché est par ailleurs étroitement liée au statut des brevets, ce qui n’est pas le cas en Europe. Et, cerise sur le gâteau : il n’existe à ce jour aucun véritable contrôle étatique des prix.
Les grands groupes cherchent donc à lancer d’abord leurs nouveaux produits aux États-Unis, afin de pouvoir protéger leur invention le plus longtemps possible (parfois durant 40-50 ans) et obtenir un prix très élevé sur le marché états-unien, qu’ils utiliseront ensuite comme base de négociation dans d’autres pays, par exemple en Europe, où le contrôle des prix est un peu plus strict.

L’Entresto, fer de lance de Novartis
Afin d’illustrer comment la pharma exploite sa position de force pour écarter toute concurrence, nous avons étudié le cas de l’Entresto de Novartis. Après des débuts plutôt poussifs, ce traitement contre l’insuffisance cardiaque, lancé en juillet 2015 aux États-Unis puis peu après en Suisse et en Europe, a vu ses ventes exploser en 2021, grâce à l’obtention d’une extension d’indication pour différents types d’insuffisances cardiaques. En Suisse, ses ventes annuelles ont plus que doublé, passant de 18 à plus de 39 millions de francs entre 2019 et 2023, selon la caisse-maladie Helsana. En 2023, l’Entresto générait le plus gros chiffre d’affaires du groupe au niveau mondial, avec plus de 6 milliards de dollars US (environ 13 % des ventes totales). En à peine huit ans, Novartis a déjà engrangé plus de 20 milliards de dollars de ventes grâce à ce produit.
Son prix officiel en Suisse pour un mois de traitement est de 130 francs environ (2,3 francs le comprimé). Comme fréquemment pour les médicaments, il est quatre fois plus élevé aux États-Unis : 668 dollars par mois, alors qu’il est un peu moins cher en Inde (10 200 roupies, soit environ 103 francs par mois). Ce prix peut sembler dérisoire en comparaison d’anticancéreux, mais la marge reste conséquente en raison d’une forte demande et d’un coût de production extrêmement bas : 0,13 franc par comprimé.
De plus, l’Entresto est une combinaison de deux vieilles molécules, dont le valsartan, qui a fait les beaux jours de Novartis comme traitement contre l’hypertension ces 25 dernières années sous le nom de marque Diovan, avec plus de 65 milliards de dollars de revenus à ce jour. D’un point de vue commercial, l’Entresto est donc une tentative de Novartis de prolonger les ventes faramineuses de son prédécesseur Diovan, tout en élargissant son public-cible aux patient·e·s souffrant d’insuffisance cardiaque. En bref : le jackpot.
L’investissement de Novartis pour développer l’Entresto a depuis longtemps été rentabilisé, avec une marge de profit astronomique. Pourtant, le géant bâlois en veut toujours plus et a initié, dès 2019, une véritable saga judiciaire aux États-Unis et en Inde afin de retarder le plus possible l’arrivée sur le marché de concurrents génériques. C’est ici que les brevets secondaires entrent en jeu.
 ©
2022 Halawi/Shutterstock
©
2022 Halawi/Shutterstock
Une jungle de brevets « frivoles »
Novartis a obtenu au moins treize brevets sur ce produit aux États-Unis, lui octroyant théoriquement une exclusivité commerciale de presque 40 ans, le double du standard prévu par les règles de l’OMC (voir tableau ci-contre). Au-delà du nombre, c’est le type de brevets et leurs dates de dépôt qui interpellent. Le médicament, une combinaison de deux molécules, est resté identique depuis le début. Seuls son utilisation (indication), son dosage et d’autres aspects comme son mode d’administration ont changé. Pourtant, à chaque fois, de nouveaux brevets secondaires ont été déposés et octroyés. Pour quels gains thérapeutiques ? Pratiquement aucun. En revanche, la durée de monopole a, elle, été prolongée de 18 ans, jusqu’en 2042.
En Europe, on compte au moins neuf demandes de brevets, dont trois sont en cours d’examen par l’OEB. Seuls trois brevets sont valides à ce jour (voir tableau ci-contre). Le brevet primaire de l’Entresto est échu depuis 2023, mais il bénéficie d’une extension de protection en Suisse jusqu’en janvier 2028, octroyée par les autorités helvétiques. La protection de l’Entresto en Europe, tous brevets octroyés confondus, court théoriquement jusqu’en mai 2036, mais si les trois demandes en cours aboutissent, elle sera alors de 40 ans – soit le double du standard de l’OMC. Deux brevets secondaires ont été révoqués (l’un par le titulaire ; l’autre suite à des oppositions), ce qui démontre que ceux-ci n’auraient pas été octroyés si l’examen par l’OEB avait été plus minutieux.
Le paysage est encore différent en Inde, où cinq brevets sur l’Entresto (commercialisé sous le nom de marque Vymada) ont été octroyés, dont quatre secondaires (voir tableau ci-contre). Le brevet primaire (échu en janvier 2023) a été contesté en justice dès 2019 par quatre fabricants de génériques, en vain. Le deuxième brevet, déposé en 2006, a fait l’objet de neuf oppositions avant son octroi, comme l’autorise la loi indienne, mais il a finalement été délivré. De nouveaux recours ont alors été déposés ; la procédure est toujours en cours. Quant aux trois autres brevets, ils pourraient bien être contestés ultérieurement en justice par des firmes indiennes. Les enjeux : ne pas retarder la commercialisation d’équivalents génériques plus abordables (au minimum 50 % moins chers que l’original) et améliorer l’accès à ce produit, dans un pays où la majorité des patient·e·s paient les traitements médicaux de leur poche.
Avec ses brevets primaires échus et plus de 85 milliards de dollars engrangés en 25 ans, grâce au Diovan et à l’Entresto, il serait temps que Novartis laisse enfin la place aux génériques. Mais le géant bâlois n’en a cure et continue à saisir systématiquement la justice pour entraver ses concurrents par l’intermédiaire de brevets secondaires abusifs.
Des plaintes en rafale aux États-Unis
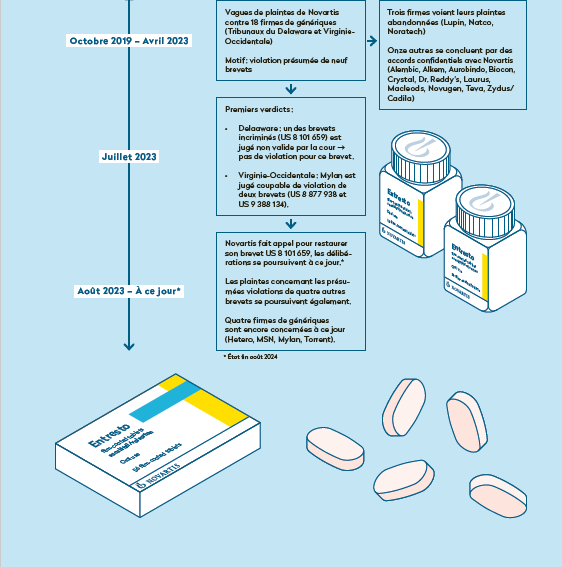
Nos recherches approfondies ont permis de retracer les nombreuses plaintes déposées par Novartis aux États-Unis pour violation présumée de brevets sur l’Entresto, sur la base de documents de justice auxquels nous avons eu accès (voir la chronologie ci-contre).
À l’origine de cette enquête, un constat frappant : durant la dernière décennie, les pharmas suisses ont saisi la justice de manière quasi routinière aux États-Unis ou en Inde dans le but d’écarter – ou du moins de fortement retarder – la concurrence, que ce soit pour l’Entresto ou le Gilenya (contre la sclérose en plaques) concernant Novartis, ou pour l’Esbriet (contre la fibrose pulmonaire) ou ses traitements contre le cancer du sein (Herceptin dans le passé, Perjeta actuellement) concernant Roche. Nous avons étudié chacun de ces cas, mais nous concentrerons ici sur celui, emblématique, de l’Entresto.
Aux États-Unis, Novartis a ainsi déposé, entre octobre 2019 et octobre 2022, pas moins de 25 plaintes pour violation présumée de neuf de ses brevets sur l’Entresto contre 18 entreprises pharmaceutiques ayant signalé leur intention d’y commercialiser des versions génériques. À noter que toutes ces plaintes, en amont de la commercialisation, étaient purement préventives. Les firmes concernées ne vendaient alors aucun générique de l’Entresto sur le marché états-unien, mais avaient simplement initié la longue procédure d’homologation auprès de la Food and Drug Administration (FDA), afin d’être prête lorsque l’exclusivité commerciale se terminera. Ces poursuites préventives sont une particularité de la loi états-unienne, appelée « patent linkage » en anglais, qui lie le statut des brevets à la procédure d’autorisation de mise sur le marché. Une situation que ne connaît heureusement pas l’Europe. Le rôle d’une agence du médicament comme Swissmedic est de s’assurer que les traitements à homologuer soient sûrs et efficaces, pas de jouer au gendarme de la concurrence.
Sur les 18 firmes attaquées en justice par Novartis, trois ont vu la plainte à leur encontre abandonnée, faute de violation constatée. Onze autres ont conclu un arrangement confidentiel avec Novartis, sans doute en s’engageant à ne pas commercialiser leur générique avant une date convenue entre les parties, en échange de l’arrêt des poursuites.
Ce type d’accord prend, en général, deux formes dans le domaine pharmaceutique :
l’octroi d’une licence contre le versement de royalties, valable à partir d’une date donnée ;
le « pay-for-delay », une tactique classique, notamment lorsqu’un brevet est chancelant. Le fabricant d’un médicament original verse alors un montant déterminé à une firme concurrente afin de l’inciter à reporter le lancement de son générique. Cette pratique, fréquente aussi en Europe, a été fortement critiquée, à plusieurs reprises, par les autorités de la concurrence. Elle coûte également très cher aux systèmes de santé, puisque le médicament continue d’être vendu au prix fort jusqu’à l’arrivée d’un générique. Dans le cas de l’Entresto, il semblerait plutôt que des accords de licence aient été conclus, même si aucune certitude n’est possible puisque les documents de justice sont soit sous scellés, soit caviardés.
La chronologie des plaintes déposées par Novartis aux États-Unis pour violation présumée de brevets sur l’Entresto est à télécharger ici en PDF.
En juillet 2023 sont tombés les deux seuls verdicts à ce jour dans cette saga judiciaire:
Dans un cas, après quatre ans de procédure à grands renforts d’expert·e·s et d’avocat·e·s, l'un des neuf brevets concernés de l'Entresto a été invalidé par le tribunal du Delaware. Novartis a immédiatement fait appel au niveau fédéral (la procédure est en cours).
Dans l’autre verdict, le tribunal de West Virginia s’est prononcé en faveur du géant bâlois, la violation de deux brevets étant confirmée contre la firme Mylan. Cette dernière n’a pas fait appel, et aucune autre information n’est décelable à partir des documents de justice, mais on peut imaginer qu’un arrangement confidentiel a été trouvé. À noter que cela s’est joué à une demi-molécule d’eau près dans la formule chimique entre le produit original de Novartis et le générique de Mylan pour faire pencher le verdict dans un sens ou dans l’autre, d’après la décision du tribunal. Ce qui montre la complexité de la procédure, mais aussi le gain de temps considérable que peuvent obtenir des géants pharmaceutiques grâce à de telles plaintes judiciaires.
Actuellement, les plaintes de Novartis ne concernent « plus que » quatre firmes et portent sur une violation présumée de quatre brevets (cinq si Novartis gagne son appel). On ignore quand les prochains verdicts tomberont, mais la procédure pourrait encore durer.
Entre mai et août 2024, sept versions génériques de l'Entresto obtiennent finalement le feu vert de la FDA, mais cette autorisation ne signifie pas encore qu'ils pourront bientôt être commercialisés et accessibles aux patient·e·s. Car Novartis saisit une nouvelle fois la justice, avec une plainte civile déposée le 30 juillet dernier, cette fois-ci à l’encontre de la FDA pour violation de ses procédures d’homologation (Novartis Pharms Corp. v. Xavier Becerra & Robert Califf, Case No. 1:24-cv-02234, US District Court of Columbia, 30/07/2024). Bien que le tribunal ait rejeté en première instance la motion de Novartis de bloquer l'autorisation de la FDA, ces firmes pourraient bien voir la mise sur le marché de leur générique de l’Entresto encore retardée aux États-Unis, selon l'issue de cette plainte ainsi que des autres litiges en cours concernant les brevets.
Entre-temps, Novartis peut continuer à engranger des milliards de dollars supplémentaires grâce à ses brevets secondaires « frivoles » – un parfait exemple d’evergreening. Tout cela sur le dos des patient·e·s et des assurances sociales, un véritable racket.
Une saga judiciaire en Inde aussi
L’Inde ayant toujours refusé d’introduire un système liant le statut des brevets à la procédure d’homologation (« patent linkage »), des versions génériques du Vymada (nom de marque de l’Entresto en Inde) ont obtenu une autorisation de mise sur le marché dès 2019. Les perspectives y sont en effet juteuses, avec un marché de la cardiologie estimé à 2,5 milliards de francs et plus de 650 000 nouveaux cas d’insuffisance cardiaque diagnostiqués chaque année. En 2019, Novartis a poursuivi quatre fabricants de génériques indiens concernés, qui ont alors contre-attaqué en demandant la révocation du brevet primaire (IN 229051). La Haute Cour de Delhi a finalement donné raison au géant bâlois en 2021, en interdisant aux firmes locales de fabriquer et de commercialiser leurs versions génériques, au moins jusqu’à expiration du brevet primaire (janvier 2023).
L’attention s’est ensuite portée sur le deuxième brevet, secondaire celui-ci (IN 414518), qui avait été octroyé en Inde malgré neuf oppositions dûment argumentées, et qui étendait l’exclusivité commerciale de Novartis jusqu’en novembre 2026. Plusieurs firmes de génériques ont dès lors saisi la justice, dès 2022, pour tenter de révoquer ce brevet secondaire après son octroi. Dans un premier temps, la Haute Cour de Delhi a suspendu, en janvier 2023, le brevet secondaire en question, avant de revenir sur sa décision quelques jours plus tard, en confirmant la validité de celui-ci. La suite est encore plus confuse, entre contre-attaque des firmes génériques pour tenter de révoquer le brevet secondaire et appels de Novartis – à notre connaissance, sans verdict à ce jour. Et la question des trois autres brevets secondaires, avec une durée de protection théorique jusqu’en février 2037, n’est pas non plus résolue.
Même si cela n’a pas été le cas jusqu’ici pour l’Entresto, les pharmas suisses se sont, plusieurs fois par le passé, cassé les dents en Inde sur les oppositions aux brevets avant octroi (ou « pre-grant »). À commencer par l’emblématique cas de l’anticancéreux Glivec de Novartis, qui s’était vu refuser son brevet primaire par les autorités indiennes. Seuls quelques pays, comme l’Inde ou la Thaïlande, utilisent cette flexibilité légale inscrite dans les accords de l’OMC. L’Europe (à l’exception du Portugal) et les États-Unis ne prévoient pas ces procédures pré-octroi, car celles-ci ont le don d’irriter Big Pharma, qui les considère comme une entrave à la bonne marche de ses affaires. Dans son accord bilatéral de libre-échange conclu récemment avec l’Inde, la Suisse a d’ailleurs obtenu d’affaiblir ces possibilités d’intervenir en amont. Une très mauvaise nouvelle pour l’accès aux médicaments et la santé publique.
Novartis poursuit l’administration Biden
Aux États-Unis, l’affaire Entresto ne se limite pas à un bras de fer entre pharmas. Novartis a aussi fait pression directement sur la FDA afin que le gendarme des médicaments états-unien n’homologue aucun générique de son produit durant sa période d’exclusivité commerciale, en cherchant toujours à gagner du temps.
En septembre 2021, le département de la Justice a annoncé l’ouverture d’une enquête civile pour de possibles rémunérations versées au corps médical en vue de pousser les ventes de l’Entresto. Novartis a déjà été dans le viseur des autorités états-uniennes pour des pratiques commerciales illégales. En 2020, la firme bâloise avait dû payer une amende de plus de 670 millions de dollars pour régler une affaire de dessous-de-table concernant plusieurs de ses produits (dont le Diovan, prédécesseur de l’Entresto). Aucune autre communication concernant la dernière enquête sur l’Entresto n’a depuis été rendue publique.
En août 2022, c’est l’arroseur arrosé : Novartis est attaquée en justice par les universités du Michigan et de Floride du Sud pour une potentielle violation de leur brevet couvrant une technique de fabrication utilisée pour l’Entresto. L’issue de cette affaire n’est pas connue, mais elle pourrait avoir été réglée sous la forme d’une compensation financière de Novartis aux deux universités.
Enfin, grâce à l’adoption de la loi sur la réduction de l’inflation (Inflation Reduction Act ou IRA), obtenue de haute lutte en août 2022 par l’administration Biden face au puissant lobby de la pharma PhRMA, l’assurance publique Medicare (pour les seniors de plus de 65 ans) a obtenu, pour la première fois de son histoire, la possibilité de négocier directement le prix des traitements les plus coûteux en termes de prise en charge. Une année plus tard, la liste des dix premiers médicaments devant passer par cette nouvelle procédure a été rendue publique, avec un nouveau prix régulé applicable dès 2026.
Parmi ces produits prioritaires : l’Entresto de Novartis, qui a coûté à Medicare environ 2,9 milliards de dollars en 2023 pour quelque 600 000 assuré·e·s. Medicare ambitionnait de faire baisser son prix d’au moins 25 %. La réaction ne s’est pas fait attendre : Novartis a poursuivi en justice le gouvernement des États-Unis le 1er septembre 2023, qualifiant cette réforme d’anticonstitutionnelle. La firme bâloise estime qu’elle s’apparente à une « expropriation de biens privés » et risque de « mettre en péril la recherche pour des médicaments innovants ».
Toutes les Big Pharma concernées ainsi que leur organisation faîtière ont également saisi la justice, en hurlant au loup. Même Roche, dont le nom n’apparaît pourtant pas dans cette première sélection, y est allée de son chantage, menaçant de retarder la commercialisation de nouveaux produits vitaux en raison de cette réforme. Comme souvent, Big Pharma fait corps afin d’éviter tout précédent fâcheux pouvant aller à l’encontre de son modèle d’affaires – d’autant plus dans son eldorado aux États-Unis, où les firmes étaient jusqu’à présent toutes-puissantes en matière de fixation des prix.
Une recherche de l’ONG Public Citizen a toutefois montré qu’en 2022, les pharmas concernées par ces négociations ont investi dans le rachat d’actions, le paiement de dividendes aux actionnaires et le salaire de leurs dirigeant·e·s en moyenne 10 milliards de dollars de plus que dans la recherche et développement (R&D) – pour Novartis, c’était 18 milliards contre 10 milliards pour la R&D. De quoi relativiser considérablement leur menace concernant l’innovation.
Novartis s’est toutefois résignée à entrer en négociation malgré sa plainte en cours. La raison : des taxes pouvant aller jusqu’à 95 % du chiffre d’affaires du produit concerné si elle ne le faisait pas. Elle a également pu soumettre une contre-offre au prix proposé par Medicare. Mi-août 2024, Medicare rendait public les nouveaux prix négociés. Ceux-ci montraient une réduction de plus de 50 % du prix de l'Entresto (295 dollars), que Novartis a immédiatemment critiqué. Si deux autres plaintes de Big Pharma ont d’ores et déjà été rejetées, celle de Novartis contre le gouvernement Biden est toujours pendante.
La Suisse doit agir contre les brevets abusifs
L’« evergreening », ou l’accumulation abusive de brevets secondaires sur les produits thérapeutiques, représente un frein à l’accès aux médicaments ainsi qu’un surcoût énorme pour les patient·e·s et la société. En Suisse, les médicaments représentent 1 franc sur 4 des dépenses de l’assurance-maladie obligatoire, dont 75 % sont dus aux produits brevetés, selon une analyse du Conseil fédéral. Avec quelle part de brevets « frivoles » permettant de maintenir un monopole – et le prix élevé qui va avec – beaucoup plus longtemps que la durée prévue par les règles de l’OMC ? Impossible à chiffrer, faute d’études précises sur le sujet en Europe. On peut toutefois parier que cette part est élevée si l’on compare le nombre limité de nouveaux médicaments lancés chaque année sur le marché avec tous les brevets pharmaceutiques déposés.
Selon l’ONG I-MAK, les abus de brevets sur les dix médicaments les plus vendus aux États-Unis se chiffrent chaque année en dizaines de milliards de dollars de coûts supplémentaires pour le système de santé. Le gouvernement des États-Unis hausse enfin le ton contre ces jungles de brevets qui nourrissent l’avidité de Big Pharma, et envisage des réformes. Le vent est-il en train de tourner outre-Atlantique ?
La Suisse, de son côté, refuse systématiquement d’agir contre les abus de propriété intellectuelle concernant l’accès aux médicaments dans les enceintes multilatérales, comme on l’a vu pendant la crise du Covid (à l’OMC) et actuellement dans le cadre du traité international sur les pandémies, en négociation à l’Organisation mondiale de la Santé (OMS). Pire, les autorités helvétiques cherchent à renforcer encore la propriété intellectuelle ou, si elles n’y parviennent pas, à limiter la marge de manœuvre des pays à plus faible revenu pour lutter contre les abus, comme on l’a vu dans le cadre de l’accord bilatéral de libre-échange conclu en mars avec l’Inde.
En tant que membre de l’OEB, qui délivre les brevets européens de la pharma, la Suisse pourrait agir à ce niveau pour proposer un examen plus minutieux des demandes. Même si l’Europe en octroie moins que les États-Unis, bien trop de brevets non mérités sont encore délivrés, comme l’illustre notre opposition de 2019 concernant l’anticancéreux Kymriah, suite à laquelle Novartis a révoqué le brevet contesté avant tout débat contradictoire. Il vaut mieux éviter que des brevets abusifs ne soient délivrés, plutôt que de devoir les combattre ensuite dans de longs et coûteux litiges. Pour cela, il est impératif de définir des règles de brevetabilité plus strictes et de les appliquer.
La Suisse s’était longtemps opposée aux brevets sur les médicaments, considérant qu’il s’agissait d’un bien essentiel pas comme les autres, avant de changer radicalement de position. Sans aller jusqu’à un tel revirement, pourquoi ne pas commencer par lutter contre les pratiques abusives de ses pharmas, qui ont des conséquences néfastes sur la santé et les finances publiques, en Suisse comme ailleurs ?